1.
常温下,常见的弱酸的电离平衡常数如下表所示:
酸 | CH3COOH | HClO | NH3·H2O | H2SO3 | H2CO3 |
电离平衡常数 | 1.75×10-5 | 4.0×10-8 | 1.8×10-5 | Ka1=1.4×10-2 Ka2=6.0×10-8 | Ka1=4.5×10-7 Ka2=4.7×10-11 |
(1)
将少量CO2气体通入NaClO溶液中的离子方程式为。
(2)
常温下,某氨水的浓度为2.0 mol·L-1
(3)
已知常温下0.1 mol·L-1的CH3COONa和NaHCO3的pH分别为8.9和8.3,而水解常数Kh(CH3COO-)<Kh( ),则NaHCO3溶液pH更小的原因是。
),则NaHCO3溶液pH更小的原因是。
①该溶液中的c(OH-)= 。
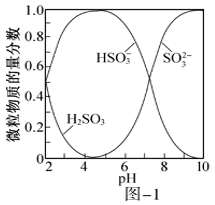
②把SO2通入氨水中,当溶液呈中性时,=。
【考点】
弱电解质在水溶液中的电离平衡;
盐类水解的应用;
能力提升
真题演练