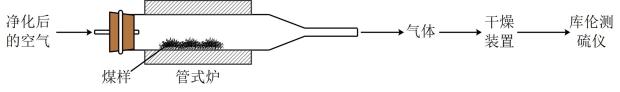
1.
碘在科研与生活中有重要应用,某兴趣小组用 溶液、
溶液、 淀粉溶液、
淀粉溶液、 溶液、
溶液、 溶液等试剂,探究反应物浓度对化学反应速率的影响,设计的实验方案如表所示。回答下列问题:
溶液等试剂,探究反应物浓度对化学反应速率的影响,设计的实验方案如表所示。回答下列问题:
实验序号 | 体积 | ||||
| 水 |
|
|
| |
a | 8.0 | 0 | 3.0 | 3.0 | 2.0 |
b | 7.0 | 1.0 | 3.0 | 3.0 | 2.0 |
c | 6.0 | 3.0 | 3.0 | 2.0 | |
已知:反应I.(慢),反应Ⅱ。
(快)。
(1)
该实验中, 淀粉溶液的作用为作(填“指示剂”或“催化剂”)。
(2)
该实验中,决定反应速率的反应为(填“反应I”或“反应Ⅱ”)。
(3)
对于
淀粉溶液的作用为作(填“指示剂”或“催化剂”)。
(2)
该实验中,决定反应速率的反应为(填“反应I”或“反应Ⅱ”)。
(3)
对于 (慢):
(4)
该实验中,当
(慢):
(4)
该实验中,当 耗尽后,溶液颜色将由色变为色。
(5)
由表中数据可知,
耗尽后,溶液颜色将由色变为色。
(5)
由表中数据可知, ,理由为。
,理由为。
①该反应中还原剂与还原产物的物质的量之比为。
②的用途有(填1种即可)。
③除了浓度外,改变该反应速率的因素有(填1种即可)。
【考点】
化学反应速率的影响因素;
能力提升
真题演练