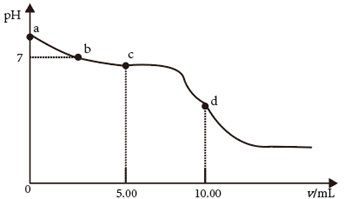
1.
常温下,物质的量浓度均为0.1mol·L-1的下列六种试剂:①HCl ②NaClO ③CH3COOH ④CH3COONa ⑤Na2CO3 ⑥NH4Cl
资料:常温下电离常数:醋酸;次氯酸
;碳酸
。回答下列问题:
(1)
溶液呈酸性,且对水的电离起到抑制作用的是(填序号,下同);溶液呈酸性,且水电离出的c(H+)>1.0×10-7mol/L的是。
(2)
试剂⑥NH4Cl溶液经常作为除锈剂,用离子方程式表示其原因。
(3)
常温下,取1mL0.1mol/L的CH3COOH溶液,加水稀释为100mL,稀释过程中离子浓度逐渐增大的是(填离子符号),然后逐滴加入0.1mol/L的CH3COONa溶液,则醋酸的电离平衡将(填“正向”“逆向”或“不”)移动,当溶液pH=7时停止滴加,此时溶液中离子浓度由大到小的顺序是,此时c(CH3COO-):c(CH3COOH)=。
(4)
分别取10mL0.1mol·L-1的NaClO和Na2CO3溶液,用pH计测量它们的pH,其中pH较大的是(填化学式),两溶液中 (填“大于”“小于”或“等于”)
(填“大于”“小于”或“等于”) 。
(5)
在NaHCO3溶液中既存在
。
(5)
在NaHCO3溶液中既存在 的电离平衡又存在
的电离平衡又存在 的水解平衡,写出
的水解平衡,写出 水解的离子方程式:,该水解常数
水解的离子方程式:,该水解常数 , 则a=(填数值)。常温下。向10mL0.1mol·L-1的Na2CO3溶液中逐滴加入10mL0.1mol·L-1的盐酸,反应后混合溶液pH7(填“大于”“小于”或“等于”,下同),溶液中
, 则a=(填数值)。常温下。向10mL0.1mol·L-1的Na2CO3溶液中逐滴加入10mL0.1mol·L-1的盐酸,反应后混合溶液pH7(填“大于”“小于”或“等于”,下同),溶液中
 。
。
【考点】
盐类水解的原理;
离子浓度大小的比较;
能力提升
真题演练