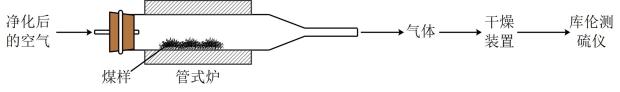
1.
 溶液和酸性
溶液和酸性 溶液发生的反应为
溶液发生的反应为 , 通过测定溶液褪色所需时间可探究外界条件对反应速率的影响,实验记录数据如下。
, 通过测定溶液褪色所需时间可探究外界条件对反应速率的影响,实验记录数据如下。
编号 |
| 酸性 | 温度/℃ | 时间/s | ||
浓度 | 体积/mL | 浓度 | 体积/mL | |||
① | 0.1 | 2.0 | 0.01 | 4.0 | 25 | |
② | 0.2 | 2.0 | 0.01 | 4.0 | 25 | |
③ | 0.2 | 2.0 | 0.01 | 4.0 | 50 | |
回答下列问题:
(1)
为了保证实验的准确性,须保证 。
(2)
利用表中的实验①和实验②可探究对速率的影响,若探究温度对速率的影响应选择实验(填表格中的实验编号)
(3)
溶液褪色的时间从长到短的顺序为(用
。
(2)
利用表中的实验①和实验②可探究对速率的影响,若探究温度对速率的影响应选择实验(填表格中的实验编号)
(3)
溶液褪色的时间从长到短的顺序为(用 表示)。
(4)
若实验①经过
表示)。
(4)
若实验①经过 褪色,则用
褪色,则用 浓度变化表示的平均反应速率
浓度变化表示的平均反应速率
 (保留两位有效数字)。
(5)
上述实验过程中,开始溶液颜色无明显变化,稍后会出现溶液突然褪色的现象。某同学设计了如下实验进行探究(已知:
(保留两位有效数字)。
(5)
上述实验过程中,开始溶液颜色无明显变化,稍后会出现溶液突然褪色的现象。某同学设计了如下实验进行探究(已知: 对速率无影响)。
对速率无影响)。

该同学认为(填离子符号)能够加快反应速率,实验1中加入的
溶液,其目的是。
【考点】
化学反应速率的影响因素;
能力提升
真题演练