1.
某小组探究SO2在盐酸中分别与铜单质和铜离子的反应,从电极反应角度分析物质氧化性和还原性的变化规律。
I.探究SO2在盐酸中与Cu2+的反应
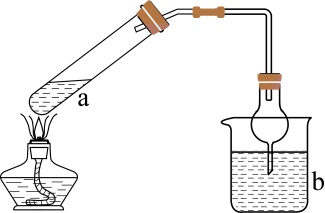
用如下装置(夹持、加热仪器略)制备SO2 , 将SO2通入0.6 mol·L-1 CuSO4溶液。通SO2一段时间,C中无明显现象;打开活塞b,加入一定体积浓盐酸后,持续通入SO2 , C中溶液变棕黄色。

(1)装置A中反应的化学方程式为,B中试剂X是。
(2)资料:CuCl难溶于水,在水溶液中存在平衡:CuCl(白色)+2Cl-[CuCl3]2-。补充实验证实了棕黄色溶液中含[CuCl3]2- , 实验方案为。
(3)SO2与CuSO4溶液反应生成SO和Cu+的电极反应式为:
氧化反应:;
还原反应:Cu2++e-=Cu+。
根据电极反应式,分析加入浓盐酸前后实验现象有差异的可能原因。
(4)综上分析,SO2在盐酸中与Cu2+反应生成[CuCl3]2-的离子方程式为。
Ⅱ.探究SO2在盐酸中与Cu单质的反应
将装置C中CuSO4溶液替换成Cu片和Na2SO4溶液,重复上述操作。未加浓盐酸之前,无明显现象。加浓盐酸之后,溶液变为棕黄色,并有黑色固体生成。
(5)经检验黑色固体是Cu2S,SO2在盐酸中与Cu单质反应的离子方程式为。
(6)为了进一步探究影响铜单质还原性的因素,进行了如下实验:
序号 | 实验装置图 | 试剂Y | 电压表 |
i |
| H2SO4溶液 | 指针几乎不偏转 |
ii | a | 指针明显偏转 | |
iii | a+b | 指针偏转幅度更大 |
实验ii中,Cu片附近溶液变棕黄色。b是。
综合上述实验可知,还原反应中,降低生成物浓度,氧化剂的氧化性增强;氧化反应中,降低生成物浓度,还原剂的还原性增强。
【考点】
化学实验方案的评价;







 )中加入酸性
)中加入酸性