1.
硫代硫酸钠( )俗称大苏打,广泛用于定影、媒染等领域,临床上用于氰化物解毒。实验室中以
)俗称大苏打,广泛用于定影、媒染等领域,临床上用于氰化物解毒。实验室中以 和
和 为主要原料制备
为主要原料制备 。回答下列问题:
。回答下列问题:
(1)
 能解毒氰化物的原理为
能解毒氰化物的原理为 , 为检验该反应产生了
, 为检验该反应产生了 , 最佳方法是取少量反应液,先向其中加入足量的盐酸,再加入(填化学式),观察到的现象是。
(2)
工业级硫化钠中混有杂质(重金属硫化物、煤粉等),需进行纯化。纯化实验装置如图1,保持水浴沸腾,回流一段时间后,过滤,将滤液冷却至室温后析出高纯硫化钠。
(3)
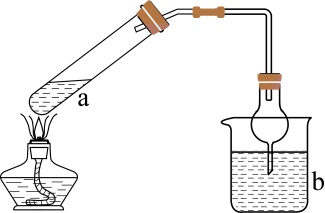
利用图2装置制备
, 最佳方法是取少量反应液,先向其中加入足量的盐酸,再加入(填化学式),观察到的现象是。
(2)
工业级硫化钠中混有杂质(重金属硫化物、煤粉等),需进行纯化。纯化实验装置如图1,保持水浴沸腾,回流一段时间后,过滤,将滤液冷却至室温后析出高纯硫化钠。
(3)
利用图2装置制备 。
(4)
实验结束后,经过一系列操作得到粗产品,测定粗产品中
。
(4)
实验结束后,经过一系列操作得到粗产品,测定粗产品中 (
( )的质量分数。精确称取0.5g硫代硫酸钠样品,用少量水溶解后滴入1~2滴淀粉溶液,再注入缓冲溶液。用
)的质量分数。精确称取0.5g硫代硫酸钠样品,用少量水溶解后滴入1~2滴淀粉溶液,再注入缓冲溶液。用 的
的 标准溶液滴定,待指示剂颜色变化稳定后停止滴定,测得消耗
标准溶液滴定,待指示剂颜色变化稳定后停止滴定,测得消耗 标准溶液的体积为VmL。(已知
标准溶液的体积为VmL。(已知 )
)

图1
将工业硫化钠溶于酒精并加热时,采取水浴加热优点是。

图2
①仪器a的名称为。
②实验开始时,打开螺旋夹并适当调节螺旋夹,一方面可以防止倒吸,另一方面可以。
③装置Ⅱ处发生反应的总化学方程式为,停止通入前要控制Ⅱ装置中溶液pH约为7而不能小于7的理由是。
④装置 Ⅲ 的作用是。
①滴定达到终点时的现象是。
②产品中的质量分数为%。
【考点】
化学实验方案的评价;
能力提升
真题演练




 )制备柠檬酸铁铵的流程和装置如图。
)制备柠檬酸铁铵的流程和装置如图。