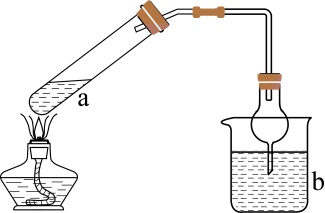
1.
四氯化锡(SnCl4)在工业上常用作媒染剂和有机合成的氯化催化剂,常温下为无色液体,沸点为114℃,熔点为-33℃,极易水解。实验室利用如下装置制备 (加热及夹持装置略)。回答下列问题:
(加热及夹持装置略)。回答下列问题:

(1)
检查装置气密性并加入相应试剂。接下来进行的操作为:①打开K1 , 通入 ;②打开
;②打开 、K3 , 通入
、K3 , 通入 ;③关闭K1 , 停止通
;③关闭K1 , 停止通 ;④加热
;④加热 片;⑤关闭K2 , 停止通
片;⑤关闭K2 , 停止通 ;⑥停止加热;⑦关闭
;⑥停止加热;⑦关闭 、K3 , 停止通
、K3 , 停止通 ;⑧打开K2 , 通入
;⑧打开K2 , 通入 。正确的操作顺序为(用序号表示);步骤②的目的是;判断制备反应结束的实验现象是。
(2)
装置c的作用是;若用一个装置代替d和e,该装置为(写出仪器名称和试剂)。
(3)
。正确的操作顺序为(用序号表示);步骤②的目的是;判断制备反应结束的实验现象是。
(2)
装置c的作用是;若用一个装置代替d和e,该装置为(写出仪器名称和试剂)。
(3)
 的晶体类型为;其遇水蒸气剧烈反应,一种产物是SnO2∙xH2O,另一种产物在空气中产生白雾,发生反应的化学方程式为。
(4)
测定
的晶体类型为;其遇水蒸气剧烈反应,一种产物是SnO2∙xH2O,另一种产物在空气中产生白雾,发生反应的化学方程式为。
(4)
测定 样品的纯度(含少量
样品的纯度(含少量 等杂质)
等杂质)
取样品溶于水,滴加
溶液产生白色沉淀,滴定达终点时消耗
溶液
;过滤,向滤液中继续滴加
溶液又产生白色沉淀,滴定达终点时消耗
溶液
。(已知:
;其他杂质与
、
溶液均不反应;
、
的摩尔质量分别为
、
),测得的样品纯度为;若滴加
溶液时,滴定终点俯视读数,则样品纯度的测量值将(填“偏大”“偏小”或“不变”)。
【考点】
化学实验方案的评价;
能力提升
真题演练