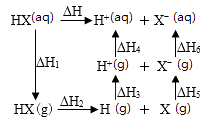1.
符合如图所示的转化关系,且当X、Y、Z的物质的量相等时,存在焓变 。满足上述条件的X、Y可能是
。满足上述条件的X、Y可能是

①C、CO ②、
③
、
④
、
⑤
、
A.
②③
B.
①③⑤
C.
①④⑤
D.
①④
【考点】
盖斯定律及其应用;