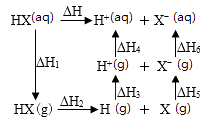1.
下图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理,下列说法不正确的是

A.
反应②为反应③提供了原料
B.
反应②也是SO2资源利用的方法之一
C.
制得等量H2所需能量较少的是系统(I)
D.
系统(I)制氢的热化学方程式为H2O(l) = H2(g) + 1/2O2(g)ΔH = +286 kJ/mol
【考点】
盖斯定律及其应用;






 B.
B.
 D.
D.