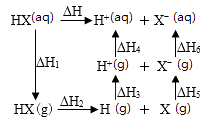1.
图像更能直接地体现化学反应的伴随现象,如能量、速率、浓度等物理量的变化。下列说法错误的是

A.
由图甲可知
 ,
, 
 , 则
, 则 B.
图乙是在一定条件下,
B.
图乙是在一定条件下, 随时间t的变化,正反应
随时间t的变化,正反应 , M点正反应速率<N点逆反应速率
C.
图丙所示反应的热化学方程式为
, M点正反应速率<N点逆反应速率
C.
图丙所示反应的热化学方程式为
 D.
图丁中t时刻改变的条件可能是增大
D.
图丁中t时刻改变的条件可能是增大 的浓度,同时减小
的浓度,同时减小 的浓度
的浓度
【考点】
盖斯定律及其应用;