反应过程:![]()
![]()
已知:a.“环己烷—乙醇—水”会形成共沸物(沸点62.6℃)。
b.分水器可以储存冷凝管冷凝的液体,当液面达到支管口时上层液体可回流到反应器中,通过下端活塞可以将密度较大的下层液体排放出去。
c.一些有机物的物理性质如表所示:
名称 | 性状 | 沸点/℃ | 密度/ | 溶解性 |
甲苯 | 无色液体、易燃、易挥发 | 110.6 | 0.8669 | 不溶于水,与乙醇互溶 |
苯甲酸 | 无色晶体 | 249(100℃升华) | 1.27 | 微溶于水,易溶于乙醇、乙醚等有机溶剂 |
苯甲酸乙酯 | 无色液体 | 212.6 | 1.05 | 微溶于热水,与乙醇、乙醚混溶 |
乙醇 | 无色液体 | 78.3 | 0.79 | 与水互溶 |
环己烷 | 无色液体 | 80.8 | 0.73 | 不溶于水 |
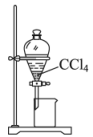
Ⅰ.用图1装置合成苯甲酸(加热及夹持装置已省略),实验步骤如下:

步骤①:在图1中向250mL三颈烧瓶中加入2.7mL甲苯和100mL水,控制温度为100℃,搅拌溶液,在石棉网上加热至沸腾。从冷凝管上口分批加入8.5g高锰酸钾(加完后用少量水冲洗内壁),继续搅拌使反应完全;
步骤②:在反应结束后向混合物中加入一定量溶液,产生黑色沉淀,趁热过滤、热水洗涤沉淀,合并滤液与洗涤液,再将其放在冰水浴中冷却,然后用浓盐酸酸化至苯甲酸全部析出;将析出的苯甲酸经过滤、冷水洗涤后放在沸水浴上干燥,得到粗产品。
Ⅱ.用图2装置合成苯甲酸乙酯(加热及夹持装置已省略)实验步骤如下:

步骤③:向图2三颈烧瓶中加入12.20g提纯后的苯甲酸、20mL环己烷、5mL浓硫酸和少许碎瓷片,并通过分液漏斗加入60mL(过量)乙醇;
步骤④:控制温度在65~70℃加热回流2h,期间不时打开旋塞放出分水器中的下层液体;
步骤⑤:反应结束后,将三颈烧瓶内反应液依次用水、饱和溶液、水洗涤。用分液漏斗分离出有机层与分水器中分离的有机层合并,水层经
处理后用适量乙醚萃取分液,然后合并至有机层;
步骤⑥:向⑤中所得有机层中加入氯化钙固体,蒸馏,接收210~213℃的馏分,得到产品12.00mL。
回答下列问题:
A. B.
C.


 (
( +H2O
+H2O





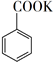 + MnO2
+ MnO2  +HCl→
+HCl→  +KCl
+KCl