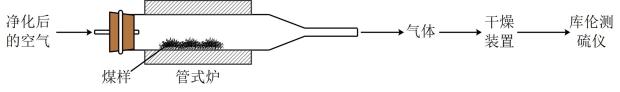
1.
请回答下列问题:
(1)
Iˉ可以作为水溶液中SO2歧化反应的催化剂,可能的催化过程如下:
(2)
某课外小组采用碘量法测定学校周边河水中的溶解氧。主要实验步骤如下:
ⅰ.SO2+4Iˉ+4H+=S↓+2I2+2H2O
ⅱ.I2+2H2O+SO2=SO+4H++2Iˉ
为探究ⅰ、ⅱ反应速率与SO2歧化反应速率的关系,实验如下:分别将18mL SO2饱和溶液加入到2mL下列试剂中,密闭放置观察现象。(已知:I2易溶解在KI溶液中)
序号 | I | II | III | IV |
试剂组成 | 0.4mol/L KI | a mol/L KI 0.2mol/L H2SO4 | 0.2mol/L H2SO4 | 0.2mol/L KI 0.0002mol I2 |
实验现象 | 溶液变黄,一段时间后出现浑浊 | 溶液变黄,出现浑浊较A快 | 无明显现象 | 溶液由棕色很快褪色,变成黄色,出现浑浊较A快 |
①Ⅱ是Ⅰ的对比实验,则a=
②比较实验Ⅰ、Ⅱ、Ⅲ,可得出的结论是
③实验表明,SO2的歧化反应速率Ⅳ>Ⅰ,原因是
![]()
请回答:
①下列说法正确的是
A.采集水样时需要记录大气压及水体温度
B.采集水样时可以扰动水体表面
C.实现氧的固定时需要加入合适的还原剂吸收水中的溶解氧
D.“氧的固定”和“酸化”都需要静置一段时间
②碘量法测定的方法是:用标准Na2S2O3溶液滴定I2(2+I2=2I−+
)。盛装标准Na2S2O3的滴定管使用前需要润洗,方法是
③下列关于滴定分析的操作,不正确的是。
A.用量筒量取25.00mL待测液转移至锥形瓶
B.滴定时要适当控制滴定速度
C.滴定时应一直观察滴定管中溶液体积的变化
D.读数时应将滴定管从架上取下,捏住管上端无刻度处,使滴定管保持垂直
【考点】
化学反应速率的影响因素;
能力提升
真题演练