1.
工业合成氨技术开创了人工固氮的重要途径,但能耗高、碳排放量大。开发温和条件下合成氨的新工艺意义重大。
(1)
氮的固定有以下常见方式:
(2)
断开氮分子中的 键,需要能量(填“吸收”或“释放”)。
(3)
已知高温不利于提高工业合成氨中
键,需要能量(填“吸收”或“释放”)。
(3)
已知高温不利于提高工业合成氨中 的平衡转化率。
(4)
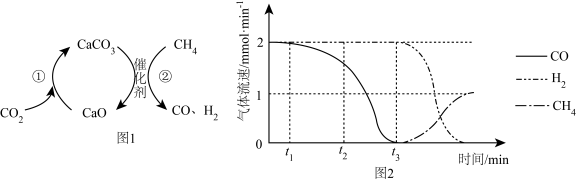
最近,我国科研人员报道了一种氯化镁循环法,可进一步降低能耗。该方法的总反应为:
的平衡转化率。
(4)
最近,我国科研人员报道了一种氯化镁循环法,可进一步降低能耗。该方法的总反应为: 。转化关系如下:
(5)
。转化关系如下:
(5)
 可用于电化学气敏传感器,工作原理如图所示,回答下列问题:
可用于电化学气敏传感器,工作原理如图所示,回答下列问题:
生物固氮:。
工业合成氨:。
通过雷电固氮:。(写出反应方程式)
①生产中依然选择高温合成氨,目的是。
②针对反应速率与平衡产率的矛盾,我国科学家提出了采用(M表示金属)复合催化剂的解决方案。做对比实验,测得反应速率如下图所示。

资料:用单位时间内每克催化剂所获得的的物质的量表示反应速率
a.无 , 催化效率最高的金属是。
b.有 , 反应速率明显增大。文献报道了
可能的催化过程如下:
i.(在M表面解离)
ii.
iii.。
在较低压强、较低温度下合成了 , 这是合成氨反应研究中的重要突破。

①A是。
②科研人员将X与混合反应,证实了氮化镁中氮元素能转化为氨。不考虑其他副反应,产物中
。

①溶液中往
电极(填“a”或“b”)移动。
②电极b的电极反应式为。
③该传感器在工作过程中电极(a)周围溶液
(填“增大”、“减小”或“不变”)。
④该传感器反应消耗的与
的物质的量之比为。
【考点】
化学反应速率的影响因素;
能力提升
真题演练