1.
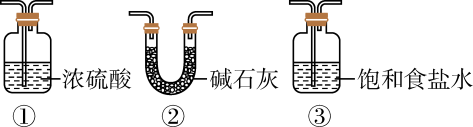
化学上常用燃烧法确定有机物的组成。用燃烧法确定有机物化学式常用的装置(夹持装置已略去)如图,这种方法是在电炉加热时用氧气氧化管内样品(M),根据产物的质量确定有机物的组成。

注:①不考虑实验过程中质量的损失;②装置Ⅲ中仅考虑氧气与样品的反应。
回答下列问题:
(1)
装置I中反应的化学方程式为。
(2)
装置Ⅱ中浓硫酸的作用为。
(3)
准确称取 有机物M(只含C、H、O三种元素中的两种或三种),充分燃烧后,装置V增重
有机物M(只含C、H、O三种元素中的两种或三种),充分燃烧后,装置V增重 , 装置V增重
, 装置V增重 。
(4)
装置Ⅵ中浓硫酸的作用为,若将装置Ⅵ去掉,对实验(填“有”或“无”)影响。
。
(4)
装置Ⅵ中浓硫酸的作用为,若将装置Ⅵ去掉,对实验(填“有”或“无”)影响。
①实验过程中,装置Ⅲ中可能观察到的现象为。
②M中所含元素为(填元素符号)。
③要确定M的分子式,还需要测定其相对分子质量,目前最精确、最快捷的测定方法是。
④相同条件下,若M的相对分子质量为的39倍且不能使酸性高锰酸钾溶液褪色,
最多与
发生加成反应,则M的结构简式为。
【考点】
探究物质的组成或测量物质的含量;
能力提升
真题演练