1.
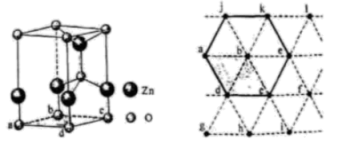
镍(Ni)是一种制造合金和催化剂的重要金属。镍不溶于水,在稀酸中可缓慢溶解,生成 。
。
(1)
EDTA(物质甲)可用于测定 含量,反应方程式如下:
(2)
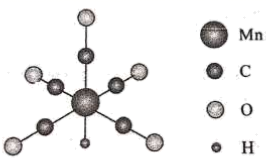
Ni形成的一种配合物
含量,反应方程式如下:
(2)
Ni形成的一种配合物 , 中心原子价电子数与配位原子提供的成键电子数之和为18。
, 中心原子价电子数与配位原子提供的成键电子数之和为18。

①基态C原子的价电子轨道表示式为;甲中C原子的杂化方式有。
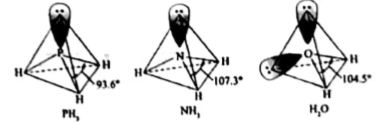
②与N同周期且第一电离能小于N的元素有种。键角(填“>”“<”或“=”),原因是。
③乙中含有的化学键类型有(填标号)。
a.范德华力 b.共价键 c.配位键 d.氢键 e.金属键
①n=。
②该配合物中键与
键的数目之比为。
【考点】
配合物的成键情况;
能力提升
真题演练

 离子组成。
离子组成。

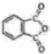 )和邻苯二甲酰亚胺(
)和邻苯二甲酰亚胺(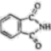 )都是合成菁的原料,后者熔点高于前者,主要原因是。
)都是合成菁的原料,后者熔点高于前者,主要原因是。