1.
[化学——选修3:物质结构与性质]
过渡金属元素铬(Cr)是不锈钢的重要成分,在工农业生产和国防建设中有着广泛应用,回答下列问题:
(1)
对于基态Cr原子,下列叙述正确的是(填标号)。
(2)
三价铬离子能形成多种配位化合物。[Cr(NH3)3(H2O)2Cl]2+中提供电子对形成配位键的原子是,中心离子的配位数为。
(3)
[Cr(NH3)3(H2O)2Cl]2+中配体分子NH3、H2O以及分子PH3的空间结构和相应的键角如下图所示。
(4)
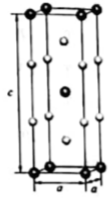
在金属材料中添加AlCr2颗粒,可以增强材料的耐腐蚀性、硬度和机械性能。AlCr2具有体心四方结构,如图所示。处于顶角位置的是原子。设Cr和Al原子半径分别为  和
和  ,则金属原子空间占有率为%(列出计算表达式)。
,则金属原子空间占有率为%(列出计算表达式)。
A.轨道处于半充满时体系总能量低,核外电子排布应为[Ar] 3d54s1
B.4s电子能量较高,总是在比3s电子离核更远的地方运动
C.电负性比钾高,原子对键合电子的吸引力比钾大
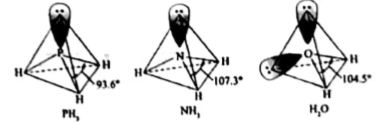
PH3中P的杂化类型是, NH3的沸点比PH3的,原因是。H2O的键角小于NH3的,分析原因。
【考点】
原子核外电子排布;
判断简单分子或离子的构型;
配合物的成键情况;
晶胞的计算;
原子轨道杂化方式及杂化类型判断;
氢键的存在对物质性质的影响;
