1.
以 、ZnO等半导体材料制作的传感器和芯片具有能耗低、效率高的优势。回答问题:
、ZnO等半导体材料制作的传感器和芯片具有能耗低、效率高的优势。回答问题:
(1)
基态O原子的电子排布式,其中未成对电子有个。
(2)
Cu、Zn等金属具有良好的导电性,从金属键的理论看,原因是。
(3)
酞菁的铜、锌配合物在光电传感器方面有着重要的应用价值。酞菁分子结构如下图,分子中所有原子共平面,所有N原子的杂化轨道类型相同,均采取杂化。邻苯二甲酸酐(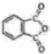 )和邻苯二甲酰亚胺(
)和邻苯二甲酰亚胺(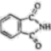 )都是合成菁的原料,后者熔点高于前者,主要原因是。
(4)
金属Zn能溶于氨水,生成以氨为配体,配位数为4的配离子,Zn与氨水反应的离子方程式为。
(5)
ZnO晶体中部分O原子被N原子替代后可以改善半导体的性能,Zn-N键中离子键成分的百分数小于Zn-O键,原因是。
(6)
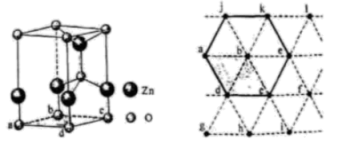
下图为某ZnO晶胞示意图,下图是若干晶胞无隙并置而成的底面O原子排列局部平面图。
)都是合成菁的原料,后者熔点高于前者,主要原因是。
(4)
金属Zn能溶于氨水,生成以氨为配体,配位数为4的配离子,Zn与氨水反应的离子方程式为。
(5)
ZnO晶体中部分O原子被N原子替代后可以改善半导体的性能,Zn-N键中离子键成分的百分数小于Zn-O键,原因是。
(6)
下图为某ZnO晶胞示意图,下图是若干晶胞无隙并置而成的底面O原子排列局部平面图。 为所取晶胞的下底面,为锐角等于60°的菱形,以此为参考,用给出的字母表示出与所取晶胞相邻的两个晶胞的底面、。
为所取晶胞的下底面,为锐角等于60°的菱形,以此为参考,用给出的字母表示出与所取晶胞相邻的两个晶胞的底面、。
 )和邻苯二甲酰亚胺(
)和邻苯二甲酰亚胺( )都是合成菁的原料,后者熔点高于前者,主要原因是。
)都是合成菁的原料,后者熔点高于前者,主要原因是。
【考点】
原子核外电子排布;
配合物的成键情况;
金属键;
原子轨道杂化方式及杂化类型判断;
氢键的存在对物质性质的影响;
