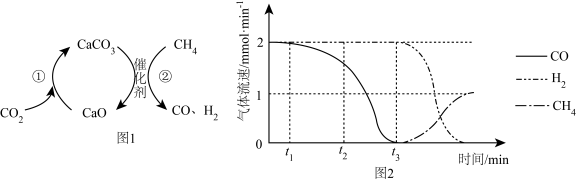
1.
图中是某化学研究小组探究外界条件对化学反应速率和化学平衡影响的图象,其中图象和实验结论表达均正确的是

A.
①是其他条件一定时,反应速率随温度变化的图象,正反应ΔH<0
B.
②是在平衡体系的溶液中溶入少量KCl晶体后化学反应速率随时间变化的图象
C.
③是在有无催化剂存在下建立的平衡过程图象,a是使用催化剂时的曲线
D.
④表明该反应正向为吸热反应
【考点】
化学反应速率的影响因素;