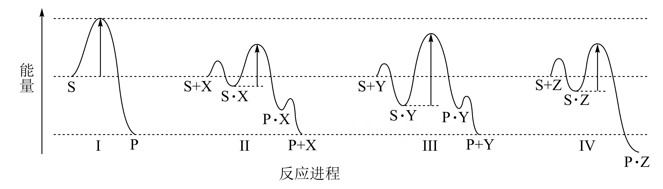
1.
决定化学反应快慢的最主要的因素是
A.
反应物本身的性质
B.
反应所处的温度
C.
反应物的浓度
D.
反应时是否加入催化剂
【考点】
化学反应速率的影响因素;