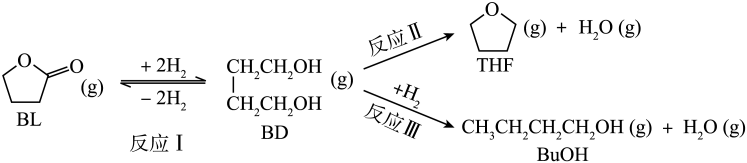
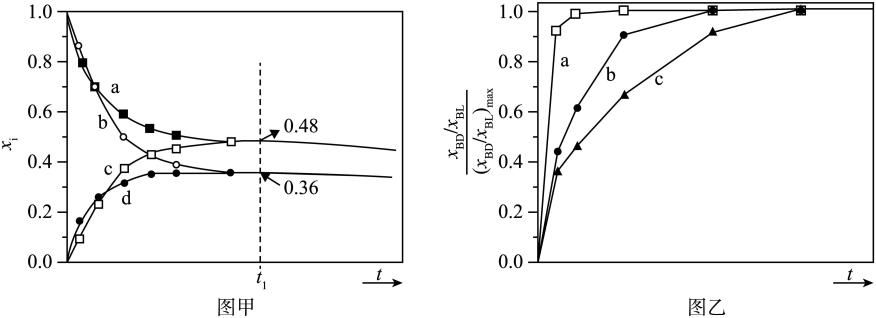
1.
研究含碳、氮的物质间转化的热效应,在日常生活与工业生产中均有很重要的意义。
(1)
已知:H2O(l)= H2O(g) △H= +44.0kJ·mol-1 , 甲烷完全燃烧与不完全燃烧的热效应如下图所示。
(2)
已知拆开1 molH-H、1 molN-H、1 mol N ≡N化学键需要的能量分别是436 kJ、391kJ、946kJ, 则N2与H2反应生成NH3的热化学方程式为。
(3)
以NH3、CO2为原料生产尿素[CONH2)2]的反应历程与能量变化示意图如下。

①写出表示甲烷燃烧热的热化学方程式:。
②CO的燃烧热△H=kJ·mol-1。

①第一步反应的热化学方程式为。
②第二步反应的△H0(填“>”、“<”或“=”)。
③从图象分析决定生产尿素的总反应的反应速率的步骤是第步反应。
【考点】
反应热和焓变;
能力提升
真题演练