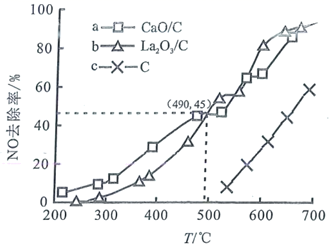
1.
利用 丁内酯(BL)制备1,4-丁二醇(BD),反应过程中伴有生成四氢呋喃(THF)和
丁内酯(BL)制备1,4-丁二醇(BD),反应过程中伴有生成四氢呋喃(THF)和 丁醇(BuOH)的副反应,涉及反应如下:
丁醇(BuOH)的副反应,涉及反应如下:
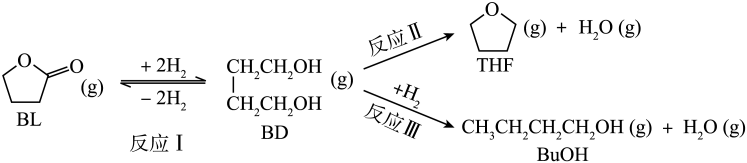
已知:①反应Ⅰ为快速平衡,可认为不受慢反应Ⅱ、Ⅲ的影响;②因反应Ⅰ在高压氛围下进行,故
压强近似等于总压。回答下列问题:
(1)
以 或BD为初始原料,在
或BD为初始原料,在 、
、 的高压
的高压 氛围下,分别在恒压容器中进行反应。达平衡时,以BL为原料,体系向环境放热
氛围下,分别在恒压容器中进行反应。达平衡时,以BL为原料,体系向环境放热 ;以BD为原料,体系从环境吸热
;以BD为原料,体系从环境吸热 。忽略副反应热效应,反应Ⅰ焓变
。忽略副反应热效应,反应Ⅰ焓变
 。
(2)
初始条件同上。
。
(2)
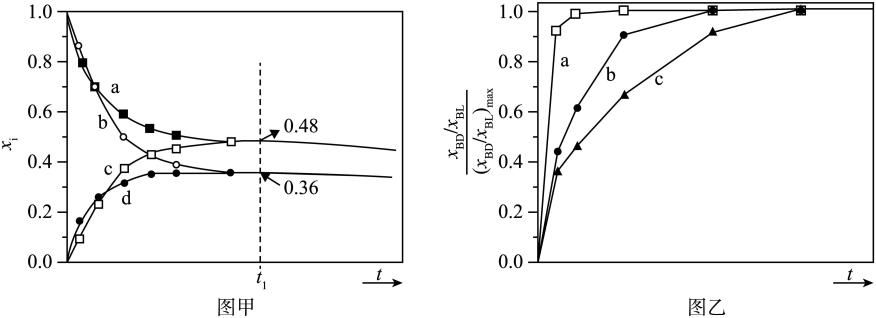
初始条件同上。 表示某物种i的物质的量与除
表示某物种i的物质的量与除 外其它各物种总物质的量之比,
外其它各物种总物质的量之比, 和
和 随时间t变化关系如图甲所示。实验测得
随时间t变化关系如图甲所示。实验测得 , 则图中表示
, 则图中表示 变化的曲线是;反应Ⅰ平衡常数
变化的曲线是;反应Ⅰ平衡常数
 (保留两位有效数字)。以BL为原料时,
(保留两位有效数字)。以BL为原料时, 时刻
时刻 ,BD产率=(保留两位有效数字)。
(3)
,BD产率=(保留两位有效数字)。
(3)
 为达平衡时
为达平衡时 与
与 的比值。
的比值。 、
、 、
、 三种条件下,以
三种条件下,以 为初始原料,在相同体积的刚性容器中发生反应,
为初始原料,在相同体积的刚性容器中发生反应, 随时间t变化关系如图乙所示。因反应在高压
随时间t变化关系如图乙所示。因反应在高压 氛围下进行,可忽略压强对反应速率的影响。曲线a、b、c中,
氛围下进行,可忽略压强对反应速率的影响。曲线a、b、c中, 最大的是(填代号);与曲线b相比,曲线c达到
最大的是(填代号);与曲线b相比,曲线c达到 所需时间更长,原因是。
所需时间更长,原因是。
【考点】
反应热和焓变;
化学平衡的影响因素;
化学平衡转化过程中的变化曲线;
化学平衡的计算;
能力提升