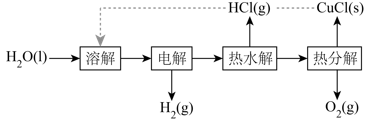
1.
大气环境中NOX的减量化排放受到国内外广泛关注。利用碳还原NO的反应为:  。回答下列问题:
。回答下列问题:
(1)
该反应在常温下可以自发进行,则反应的  0(填“
0(填“  ”“
”“  ”或“
”或“  ”),有利于提高NO平衡转化率的条件是(任写一条)。
(2)
以上反应可分为如下四步反应历程,写出其中第三步的反应:
(3)
对比研究活性炭负载钙、镧氧化物的反应活性。在三个反应器中分别加入C、
”),有利于提高NO平衡转化率的条件是(任写一条)。
(2)
以上反应可分为如下四步反应历程,写出其中第三步的反应:
(3)
对比研究活性炭负载钙、镧氧化物的反应活性。在三个反应器中分别加入C、  、
、  ,通入
,通入  使其浓度达到
使其浓度达到  。不同温度下,测得第2小时NO去除率如图所示:
。不同温度下,测得第2小时NO去除率如图所示:
第一步:
第二步:
第三步:
第四步:
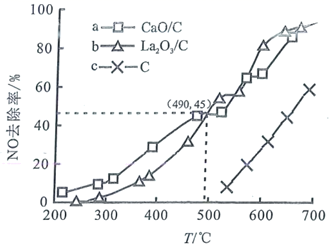
①据图分析,490℃以下,三种情况下反应的活化能最小的是(用a、b、c表示); 、
去除NO效果比C更好,其依据是(写一条)。
②上述实验中,490℃时,若测得 对NO的去除率为60%,则可能采取的措施是。
A.及时分离出 B.压缩体积
C.恒容下,向体系中通入氮气 D.寻找更好的催化剂
③490℃时的反应速率
,该温度下此反应的平衡常数为121,则反应达平衡时NO的去除率为(保留二位有效数字)。
【考点】
化学平衡的影响因素;
能力提升
真题演练