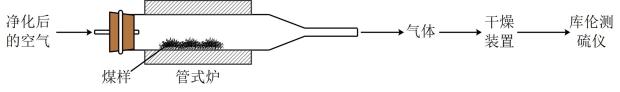
1.
某兴趣小组同学设计实验探究 溶液与草酸(
溶液与草酸( )溶液的反应及其反应速率,实验过程如下:
)溶液的反应及其反应速率,实验过程如下:
装置 | 序号 | 试剂A | 溶液褪色所需的时间 |
| ① | 2mL 0.1 2mL 4 | 45s |
② | 2mL 0.2 2mL 4 | 27s | |
③ | 2mL 0.1 2mL 2 | 63s |
(1)
实验时需要配制100mL 0.1
 溶液,用到的玻璃仪器有烧杯、量筒、玻璃棒、胶头滴管、。
(2)
实验过程中观察到溶液中产生气泡,该气体的主要成分是。
(3)
对比实验①③或,可以得出结论:。
(4)
甲同学发现实验过程中溶液褪色先慢后快,经查阅资料知道
溶液,用到的玻璃仪器有烧杯、量筒、玻璃棒、胶头滴管、。
(2)
实验过程中观察到溶液中产生气泡,该气体的主要成分是。
(3)
对比实验①③或,可以得出结论:。
(4)
甲同学发现实验过程中溶液褪色先慢后快,经查阅资料知道 对该反应起催化作用,该同学设计如下实验证明:
(5)
乙同学为了更好地观察溶液褪色的快慢,将实验中
对该反应起催化作用,该同学设计如下实验证明:
(5)
乙同学为了更好地观察溶液褪色的快慢,将实验中 溶液的体积增大至4mL,并改变了试剂的滴加顺序(如图1所示),同时用色度计测定反应过程中
溶液的体积增大至4mL,并改变了试剂的滴加顺序(如图1所示),同时用色度计测定反应过程中 溶液的透光率(
溶液的透光率( 溶液浓度越大,透光率越小)。实验结果如图2所示:
溶液浓度越大,透光率越小)。实验结果如图2所示:
取2mL 0.1溶液和2mL 4
溶液于试管中,再加入少量的,滴加,记录溶液褪色所需的时间。

实验中发现溶液的褪色经历了紫红色→棕黄色→无色几个阶段。
经查阅资料得知:
i.与
反应,
先缓慢自分解为
;
ii.能发生反应:
(棕黄色);
iii.易分解为
和
。
①由图2可得出结论:改变试剂的滴加顺序后,的浓度越小,。
②根据以上结论分析,其他条件不变,如果适当升高酸性溶液的pH,溶液的透光率达到100%所需的时间会。(填“增加”“减少”或“不变”)。
③当的浓度越小时,观察到溶液显棕黄色的时间越长,从平衡角度分析其原因:。
【考点】
化学反应速率的影响因素;
能力提升
真题演练