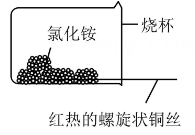
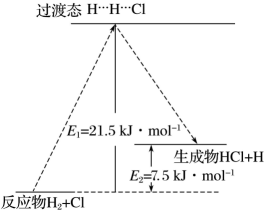
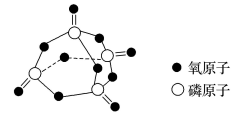
1.
为防止海水中钢铁的腐蚀,可将金属 连接在钢铁设施表面,减缓水体中钢铁设施的腐蚀,如图所示。下列有关说法正确的是
连接在钢铁设施表面,减缓水体中钢铁设施的腐蚀,如图所示。下列有关说法正确的是

A.
金属 做正极,钢铁做负极
B.
做正极,钢铁做负极
B.
 极的电极反应式为
极的电极反应式为 C.
过程中化学能
C.
过程中化学能 转化为电能
D.
将金属
转化为电能
D.
将金属 换成金属
换成金属 也能起到保护作用
也能起到保护作用
【考点】
电极反应和电池反应方程式;
金属的电化学腐蚀与防护;
原电池工作原理及应用;












 图2
图2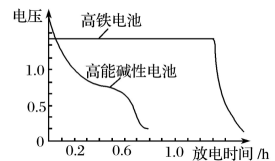
 乙
乙