1.
2-溴戊二酸二甲酯(相对分子质量为239)是某抗癌药物的重要中间体,其制备的反应原理如图所示:

制备装置如图所示(夹持装置已略去):

实验步骤如下:
步骤一:制备
将10.0g戊二酸(固态,相对分子质量为132)加入到三颈烧瓶中,再向其中加入三氯甲烷25mL,搅拌均匀,保持78℃条件下,依次缓慢滴加12mL氯化亚砜、3滴催化剂、10mL液溴,随后回流;回流完毕后,将三颈烧瓶置于冰盐浴中,将溶液温度降到-10℃后,缓慢滴加25mL甲醇(沸点64.7℃)保持滴加过程中温度不超过0℃。
步骤二:除杂
向三颈烧瓶中加入25mL饱和碳酸氢钠溶液进行洗涤,分液除去上层水相,下层有机相再用25mL饱和氯化钠溶液洗涤3次,洗涤完毕,“用无水硫酸镁干燥,过滤。
步骤三:提纯
过滤后的液体置于热浴容器中(外温170℃),接上精馏装置,进行减压蒸馏。
步骤四:收集
收集100—110℃的馏分,得到10.86g无色透明油状液体。
回答下列问题:
(1)
使用装置A的优点是,三颈烧瓶宜选择的规格是(填标号)。
(2)
步骤一中采取“温度降到-10℃”“缓慢滴加”这些措施的可能原因有。
(3)
步骤二中用饱和氯化钠溶液洗涤的目的是。
(4)
步骤三中使用减压蒸馏的目的是。
(5)
中间产物Ⅰ比戊二酸的沸点低很多的原因是,反应中生成中间产物1(戊二酰氯)的同时得到两种有刺激性气味的气体,该反应的化学方程式为。
(6)
从环保角度分析,该实验装置存在明显不足之处,解决的办法是。
(7)
本实验的产率约是 。
A.
30%
B.
50%
C.
60%
D.
80%
A.50mL B.150mL C.200mL D.500mL
a.减缓反应速率
b.防止高温下发生复杂的有机副反应
c.避免原料挥发,使反应物充分反应
【考点】
常用仪器及其使用;
蒸馏与分馏;
能力提升
真题演练






 +H2O
+H2O

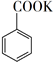 + MnO2
+ MnO2  +HCl→
+HCl→  +KCl
+KCl