1.
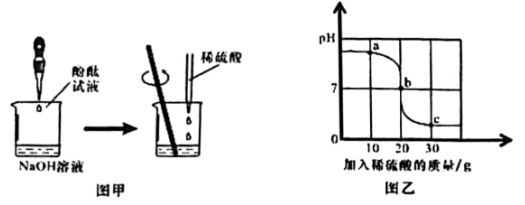
中和反应是一类重要的化学反应,兴趣小组利用图1研究稀硫酸与氢氧化钠溶液反应,并用和电导率传感器测定反应过程。
资料卡片 电导率是物理学概念,也可以称为导电率。电导率是以数字表示的溶液传导电流的能力。电导率越大,说明单位体积溶液中离子个数越多,导电能力越强。 |

【实验准备】
(1)按图1装置连接好仪器(固定装置省略),装置中盛装的液体是,装置
的作用是。
【数据采集】小组同学分工明确,记录了和电导率的变化(如图2和图3)。

【数据分析】
(2)①图2中(填字母)段表示反应发生的过程。
A. B.
C.
②图3中0~90s溶液电导率下降的原因是。120s时溶液中的溶质是。
【学习迁移】
(3)有同学认为这种方法非常科学和精准,避免了酸碱指示剂的误差。因此想用该装置测定硫酸与氢氧化钡反应的相关数据。写出该反应的化学方程式。当反应恰好完全时,电导率约等于。
【提出质疑】
(4)有同学认为如果测定稀硫酸与氢氧化钡反应的电导率存在一定误差,会造成反应完成假象。你认为造成假象的原因是。
【考点】
酸的化学性质;
中和反应及其应用;
溶液的酸碱性与pH值的关系;
基础巩固
能力提升
变式训练
拓展培优
真题演练










 实验①验证柠檬酸溶液呈酸性
实验①验证柠檬酸溶液呈酸性 实验②验证柠檬酸能与金属反应
实验②验证柠檬酸能与金属反应 实验③验证柠檬酸能与碱反应
实验③验证柠檬酸能与碱反应 实验④验证柠檬酸能与碳酸盐反应
实验④验证柠檬酸能与碳酸盐反应