1.
过碳酸钠(2Na2CO3-H2O2)是白色粉末固体,易溶于水,同时具有Na2CO3和H2O2的化学性质,遇热水能迅速产生大量气泡。项目学习小组同学对过碳酸钠进行以下探究。
活动一:探究过碳酸钠与水反应的生成物
(1)
完成下列实验导图:①②;③。
(2)
对比实验1和实验3,可探究是否为影响过碳酸钠制氧速率的因素。
(3)
预测实验2比实验1产生气泡的速率(填“快”或“慢”)。
(4)
为探究过碳酸钠的质量与水的体积之比是否影响过碳酸钠的制氧速率,与实验3对比,则实验4的方案为:,观察产生气泡的速率。
(5)
由上图可知,制备过碳酸钠时选择的最佳稳定剂是(填标号),理由是。

活动二:探究影响过碳酸钠制氧速率的因素
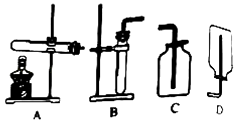
小组同学根据下表相关数据,按照下图装置分别进行实验,观察并记录现象。
实验 序号 | 固体药品 | 水 | 现象 (产生气泡的速率) | ||
过碳酸钠 | MnO2 | 温度 | 体积 | ||
1 | 5g | 20℃ | 60mL | ||
2 | 5g | 1g | 20℃ | 60mL | |
3 | 5g | 60℃ | 60mL | ||
4 | 5g | · | * | ||

活动三:探究过碳酸钠的储存稳定性
【资料】
以活性氧质量分数为重要指标来衡量过碳酸钠的储存稳定性。活性氧质量分数≥13%,其储存稳定性为优。
小组同学以不同种类稳定剂制备的过碳酸钠产品,测得其活性氧质量分数随存储时间的变化如图。

【考点】
氧气的实验室制法;
盐的化学性质;
能力提升
真题演练