1.
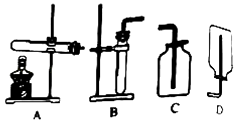
根据下列实验装置图,回答有关问题。

(1)
图中标有①的仪器名称是。
(2)
实验室用氯酸钾和二氧化锰制取氧气,应选用的装置组合是(填字母),反应的化学方程式为,其中二氧化锰的作用是。
(3)
实验室用锌和稀硫酸制取氢气的化学方程式为,用E装置收集氢气,气体应从(填“a”或“b”)端通入。
(4)
小强和小明两位同学对黄色的FeCl3溶液产生了浓厚的兴趣,查阅资料获得如下信息:
①FeCl3能与Cu、Fe、Al等金属反应生成FeCl2 , 如2FeCl3+Cu=2FeCl2+CuCl2;
②FeCl3溶液能使无色的苯酚溶液变成紫色。
(提出问题)①FeCl3溶液与金属铝反应有哪些现象?
②FeCl3溶液中的哪些粒子使苯酚溶液变成紫色?
(实验探究)取适量FeCl3溶液于试管中,进行如下实验:

(思考与交流)
①实验前,铝箔表面需要进行打磨处理,其目的是。
②FeCl3溶液的pH7(填“>”、“<”或“=”)。
③溶液由黄色变成浅绿色的化学反应方程式为。
④D中无色溶液的溶质是(填化学式)。
⑤经分析,小强同学认为是Fe3+使苯酚溶液变成紫色,但小明同学认为若要得出此结论还需补做如下实验:在苯酚溶液中滴加稀盐酸,观察溶液是否变成紫色。小明的理由是。
【考点】
氧气的实验室制法;
盐的化学性质;