1.
小明在市场看到,鱼老板将一勺白色粉末加入水中,水中奄奄一息的鱼很快张开嘴,活蹦乱跳起来,小明对这种“白色粉末”很感兴趣,与小刚进行了相关探究.
(1)
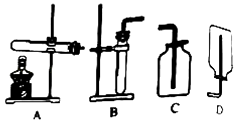
【查阅资料】这种“白色粉末”的主要成分是过碳酸钠(化学式为Na2CO4),常温下,与水反应生成氧气.【实验1】小明选用如图所示装置中的(选填序号)进行过碳酸钠与水的反应并收集产生的气体,经检验该气体是氧气,检验方法是
(2)
【提出问题】过碳酸钠与水反应后得到的溶液M中溶质的成分是什么?
(3)
【实验3】小刚取溶液M,滴加稀HCl,观察到,证明溶液中一定含有Na2CO3 , 从而否定了猜想二.Na2CO3与稀HCl反应的化学方程式为.
(4)
【实验4】为进一步确定溶液M中是否含有NaOH,他们向溶质M中滴加CaCl2溶液至不再产生沉淀为止,取上层溶液,加入,无明显现象.证明溶液中无NaOH溶液,猜想一正确.该实验中用CaCl2溶液而不用饱和石灰水,原因是:.
【作出猜想】根据过碳酸钠与水的组成作出三种猜想.
猜想一:Na2CO3;猜想二:NaOH;猜想三:Na2CO3和NaOH.
【实验2】小明取溶液M,滴加CaCl2溶液,观察到有白色沉淀生成,他认为白色沉淀是CaCO3 , 溶液中一定含有Na2CO3 . 小刚提出质疑,产生的白色沉淀不一定是CaCO3 , 他的理由是:.
【反思拓展】
①根据过碳酸钠的性质,保存时应注意防潮.
②检验A、B两种物质是否同时存在,一定要考虑二者性质的互相干扰问题.
【考点】
氧气的实验室制法;
氧气的检验和验满;
碱的化学性质;
盐的化学性质;
实验探究物质的组成成分以及含量;
能力提升



