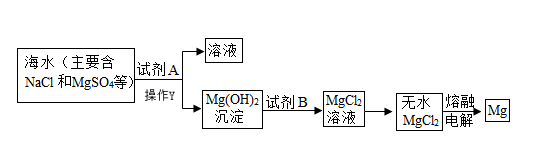
1.
实验室中有两瓶未贴标签的化肥样品,已知可能是碳酸氢铵和硝酸钾中的各一种。化学兴趣小组的同学为确定各是哪种物质,进行了如下实验探究。
(1)
①小明各取少量两种白色固体于试管中,在酒精灯上加热,其中一种固体有刺激性气味的气体放出,则该固体为(写化学式),写出该反应的化学方程式。
(2)
已知固体混合物A中可能含有NH4NO3和KCl或两者之一,另有一固体混合物B,可能含有CuO,BaCl2、Na2SO4、Na2CO3中的两种或多种。按下图所示进行实验探究,实验现象如图中所述(设过程中所有发生的反应都恰好完全反应)
②小红各取少量两种白色固体,分别加入A、B两支试管中,各滴加适量水,振荡,得到两种无色溶液。分别向这两种无色溶液中滴加适量(选填下列序号之一),其中一只试管产生了能使澄清石灰水变浑浊的气体,由此确定该试管中的物质是碳酸氢铵。
A.氢氧化钠溶液 B.氯化钠溶液 C.稀盐酸 D.碳酸钠溶液

请根据实验过程和图示信息,进行分析推理,试回答下列问题:
①气体C的化学式为。
②固体混合物A中一定存在的物质是(填化学式);固体混合物B中一定不存在的物质是(填化学式)。
③步骤Ⅱ中一定发生的化学反应方程式。
④溶液G中一定大量存在的阳离子为(写离子符号)。
⑤根据上述实验现象,固体混合物A中还不能确定是否存在的物质为(填化学式),得出此结论的理由是。
【考点】
酸的化学性质;
盐的化学性质;
能力提升
真题演练