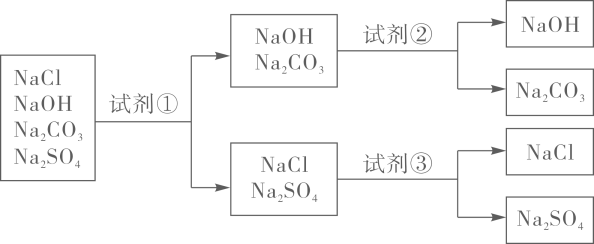
1.
物质的组成和结构决定物质的性质。小明同学对酸的有关化学性质进行梳理和总结,并预测了硫酸氢钠的化学性质。请完成下列问题。
(1)
基于微观视角分析酸的共性
(2)
基于微观视角分析酸的差异性
(3)
预测陌生物质的化学性质
烧杯和
中分别盛有稀盐酸和稀硫酸,向两烧杯中分别加入紫色石蕊溶液,出现的相同实验现象是,现象相同的原因是酸溶液中均含有相同的(填离子符号)。
向烧杯和
中分别滴加硝酸钡溶液,烧杯
中反应的微观示意图如图所示,反应的化学方程式为:,微观角度分析该反应的实质为;烧杯
中无明显现象,造成两烧杯中现象不同的原因是两溶液中的不同。

①烧杯中盛有硫酸氢钠溶液。向该溶液中加入氧化铁,预期现象为。
②请根据硫酸氢钠溶液中所含的微粒,预测硫酸氢钠能与下列试剂反应的有(填字母序号)。
A.硝酸钡溶液 B.硝酸钾溶液 C.氯化铜溶液 D.碳酸氢钠溶液
【考点】
酸的化学性质;
碱的化学性质;
盐的化学性质;
能力提升
真题演练