1.
中国从 人工合成淀粉被国际学术界认为是影响世界的重大颠覆性技术,合成步骤由60多步缩减到11步,突破了自然界淀粉合成的复杂调控障碍。其中
人工合成淀粉被国际学术界认为是影响世界的重大颠覆性技术,合成步骤由60多步缩减到11步,突破了自然界淀粉合成的复杂调控障碍。其中 加氢的主要反应如下。
加氢的主要反应如下。
反应ⅰ:
反应ⅱ:
向密闭容器中通入的混合气体,在不同压强(
、
)、不同温度下,平衡体系中
的转化率、
和CO的选择性随温度的变化如图所示。
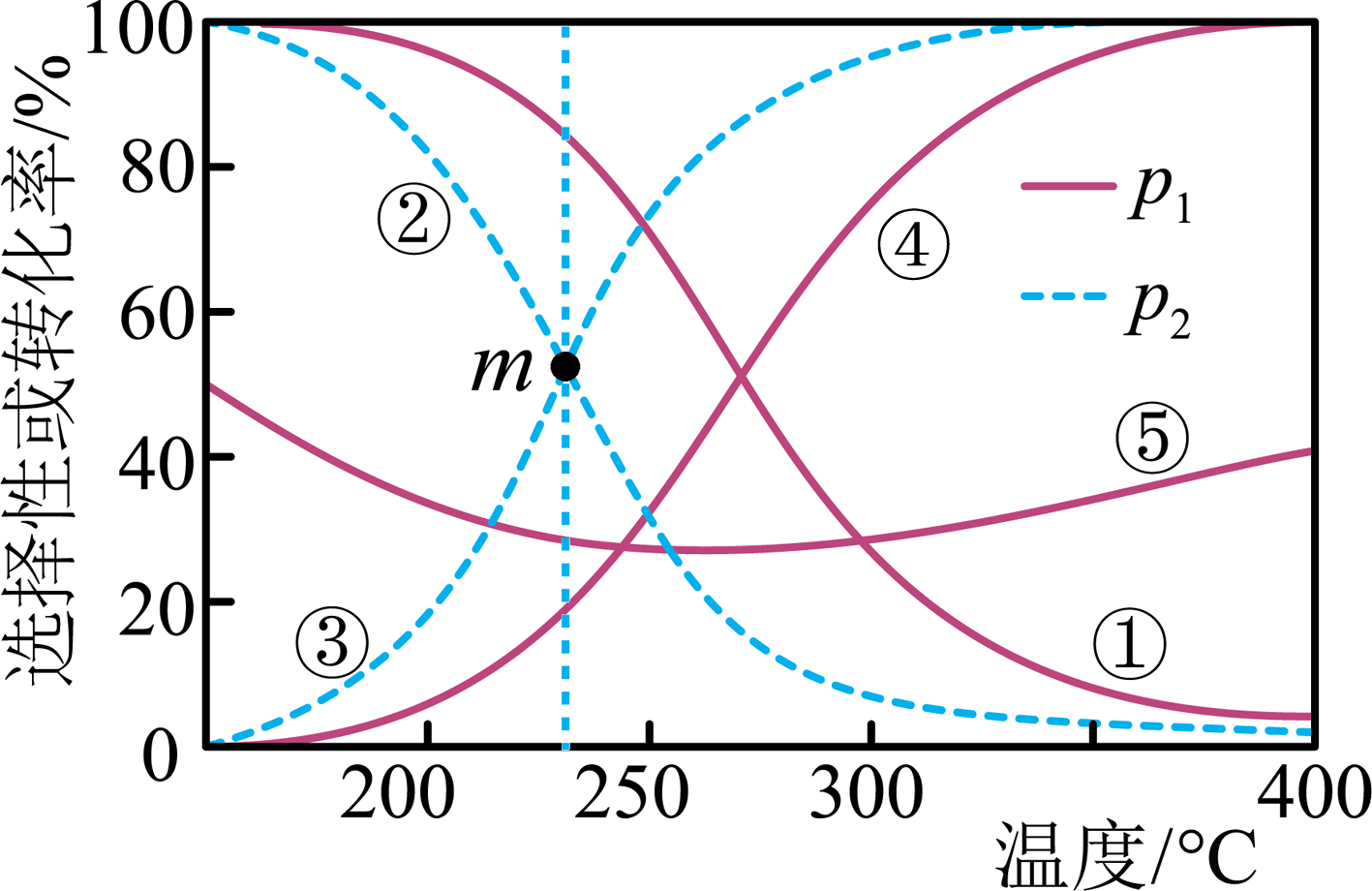
下列说法错误的是( )
A.
压强: B.
曲线①、⑤分别表示平衡体系中
B.
曲线①、⑤分别表示平衡体系中 的选择性和
的选择性和 的转化率
C.
235℃时,m点体系中
的转化率
C.
235℃时,m点体系中 D.
随着温度升高,
D.
随着温度升高, 与
与 的平衡转化率之比
的平衡转化率之比 先减小后增大
先减小后增大
【考点】
化学平衡移动原理;
化学平衡转化过程中的变化曲线;
基础巩固
能力提升
变式训练
拓展培优
真题演练