1.
学习小组在老师的指导下对氢氧化钠、氧氧化钙的性质进行探究。
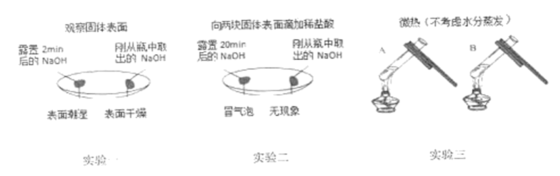
I.探究的性质:同学们设计如图所示实验。

(1)
实验一中酚酞试液变红,说明 溶液显性。
(2)
实验二、实验三验证了
溶液显性。
(2)
实验二、实验三验证了 能与某些发生反应(填物质类别)。写出实验三中发生反应的化学方程式:。
(3)
实验四中滴入
能与某些发生反应(填物质类别)。写出实验三中发生反应的化学方程式:。
(3)
实验四中滴入 浓溶液后观察到的现象是。
(4)
II.探究
浓溶液后观察到的现象是。
(4)
II.探究 的性质:甲、乙两位同学分别取
的性质:甲、乙两位同学分别取 , 固体于试管中,各加入
, 固体于试管中,各加入 水,充分振荡,均得到悬浊液。
(5)
如下图所示,乙同学向盛悬浊液的试管中滴入2滴酚酞试液,振荡、静置后,观察到试管底部有固体,上层清液呈红色,然后向试管中逐滴加入稀盐酸至上层清液变为无色,该过程中发生反应的实质是;再将试管振荡、静置,上层清液又变成红色,其原因。
水,充分振荡,均得到悬浊液。
(5)
如下图所示,乙同学向盛悬浊液的试管中滴入2滴酚酞试液,振荡、静置后,观察到试管底部有固体,上层清液呈红色,然后向试管中逐滴加入稀盐酸至上层清液变为无色,该过程中发生反应的实质是;再将试管振荡、静置,上层清液又变成红色,其原因。
甲同学将盛悬浊液的试管静置后,吸取上层清液滴入盛有少量碳酸钠溶液的试管中,观察到有白色沉淀产生,该反应的化学方程式为。

【考点】
碱的化学性质;
实验探究物质的性质或变化规律;
能力提升
真题演练