1.
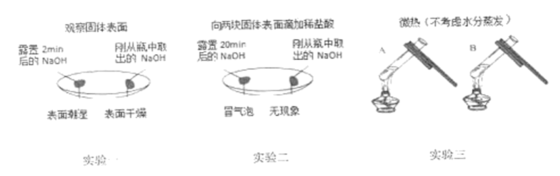
某校初三化学兴趣小组的同学为验证氢氧化钠的化学性质做了如下实验探究。请你根据实验回答有关问题。

(1)
实验1的试管中可观察到的实验现象是。
(2)
甲同学观察到实验2无明显现象,他得出结论:氢氧化钠与盐酸不发生反应。乙同学认为甲同学的结论不正确,他改进了该实验方案:先向氢氧化钠溶液中滴入几滴并振荡,再逐滴滴入稀盐酸,观察到溶液由红色变无色,由此可知氢氧化钠与稀盐酸(填“发生”或“不发生”)化学反应。
(3)
小亮同学由实验2联想到在氢氧化钠溶液中通入二氧化碳也没有明显现象,那么二氧化碳与氢氧化钠是否发生了化学反应呢?(本实验中忽略CO2溶于水)
I、王敏同学从实验3得到的溶液中取出少量,加入试管中,滴入溶液,观察到有白色沉淀生成,其反应的化学方程式为,证明二氧化碳与氢氧化钠发生了化学反应。
Ⅱ、为了验证CO2和NaOH溶液发生了化学反应,晓霞同学设计了实验4图示实验方案,当观察到现象时,证明二氧化碳与氢氧化钠溶液发生了化学反应。
Ⅲ、通过对氢氧化钠化学性质的探究,同学们得出保存氢氧化钠固体的方法是。
【考点】
碱的化学性质;
实验探究物质的性质或变化规律;
能力提升
真题演练