1.
 有效转化是研究“碳中和”的重要方向。
有效转化是研究“碳中和”的重要方向。
(1)
 可用于人工合成淀粉,其中前两步的反应如下图所示。
(2)
CO2催化加氢可合成乙烯,反应为2CO2(g)+6H2(g)
可用于人工合成淀粉,其中前两步的反应如下图所示。
(2)
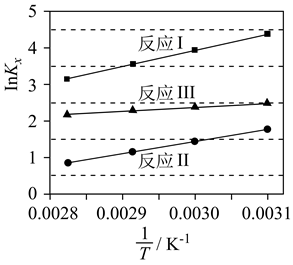
CO2催化加氢可合成乙烯,反应为2CO2(g)+6H2(g) C2H4(g)+4H2O(g) ΔH<0,在恒压密闭容器中,起始充入2molCO2(g)和6molH2(g)发生反应,不同温度下达到平衡时各组分的体积分数随温度的变化如图所示。
C2H4(g)+4H2O(g) ΔH<0,在恒压密闭容器中,起始充入2molCO2(g)和6molH2(g)发生反应,不同温度下达到平衡时各组分的体积分数随温度的变化如图所示。

已知
则的
(用
、
、
表示)。

①下列说法正确的是
A.b点时:2v正(H2)=3v逆(H2O)
B.a、b、c三点的平衡常数:Ka>Kc>Kb
C.将H2O(g)液化分离可提高C2H4的产率
D.活性更高的催化剂可提高CO2的平衡转化率
②表示C2H4体积分数随温度变化的曲线是(填“k”“l”“m”或“n”)
③若d点表示240℃某时刻H2的体积分数,保持温度不变,则反应向(填“正”或“逆”)反应方向进行。
④205℃,反应达b点所用时间为tmin,则此过程中用CO2表示的反应速率是mol/min。若平衡时b点总压为P,则平衡常数Kp=(列出计算式,以分压表示,分压=总压×物质的量分数)。
⑤其他条件相同,分别在催化剂X、Y作用下发生该反应,测得相同时间CO2的转化率与温度的关系如下图所示。使用催化剂X,当温度高于302℃,CO2转化随着温度升高而下降的原因是。

【考点】
化学平衡转化过程中的变化曲线;
化学反应速率与化学平衡的综合应用;
能力提升
真题演练





 △H1
△H1 △H2
△H2