1.
2-甲氧基-2-甲基丁烷(TAME)常用作汽油原添加剂。在催化剂作用下,可通过甲醇与烯烃的液相反应制得,体系中同时存在如图反应:
反应Ⅰ: ![]() +CH3OH
+CH3OH
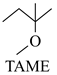 △H1
△H1
反应Ⅱ: ![]() +CH3OH
+CH3OH
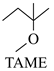 △H2
△H2
反应Ⅲ: ![]()
![]() △H3
△H3
回答下列问题:
(1)
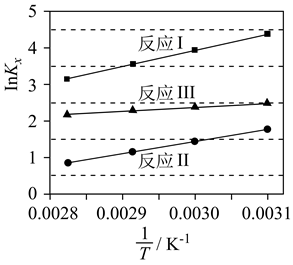
反应Ⅰ、Ⅱ、Ⅲ以物质的量分数表示的平衡常数Kx与温度T变化关系如图所示。据图判断,A和B中相对稳定的是 (用系统命名法命名);  的数值范围是(填标号)。
(2)
为研究上述反应体系的平衡关系,向某反应容器中加入1.0molTAME,控制温度为353K,测得TAME的平衡转化率为α。已知反应Ⅲ的平衡常数Kx3=9.0,则平衡体系中B的物质的量为mol,反应Ⅰ的平衡常数Kx1=。同温同压下,再向该容器中注入惰性溶剂四氢呋喃稀释,反应Ⅰ的化学平衡将 (填“正向移动”“逆向移动”或“不移动”)平衡时,A与CH3OH物质的量浓度之比c(A):c(CH3OH)=。
(3)
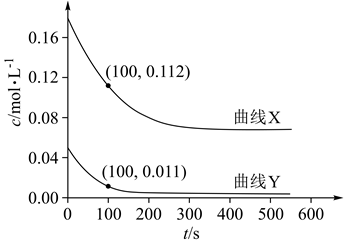
为研究反应体系的动力学行为,向盛有四氢呋喃的另一容器中加入一定量A、B和CH3OH。控制温度为353K,A、B物质的量浓度c随反应时间t的变化如图所示。代表B的变化曲线为 (填“X”或“Y”);t=100s时,反应Ⅲ的正反应速率v正逆反应速率v逆(填“>”“<”或“=)。
的数值范围是(填标号)。
(2)
为研究上述反应体系的平衡关系,向某反应容器中加入1.0molTAME,控制温度为353K,测得TAME的平衡转化率为α。已知反应Ⅲ的平衡常数Kx3=9.0,则平衡体系中B的物质的量为mol,反应Ⅰ的平衡常数Kx1=。同温同压下,再向该容器中注入惰性溶剂四氢呋喃稀释,反应Ⅰ的化学平衡将 (填“正向移动”“逆向移动”或“不移动”)平衡时,A与CH3OH物质的量浓度之比c(A):c(CH3OH)=。
(3)
为研究反应体系的动力学行为,向盛有四氢呋喃的另一容器中加入一定量A、B和CH3OH。控制温度为353K,A、B物质的量浓度c随反应时间t的变化如图所示。代表B的变化曲线为 (填“X”或“Y”);t=100s时,反应Ⅲ的正反应速率v正逆反应速率v逆(填“>”“<”或“=)。
A.<-1 B.-1~0 C.0~1 D.>1
【考点】
反应热和焓变;
化学平衡常数;
化学平衡转化过程中的变化曲线;
化学反应速率与化学平衡的综合应用;
能力提升




