1.
氯乙烯是制备塑料的重要中间体,可通过乙炔选择性催化加氢制备。已知:
I.
II.
III.
VI.部分化学键的键能如表所示。
化学键 | C-C | C=C | C-H | C-Cl | H-Cl |
键能(kJ/mol) | 347.7 | x | 413.4 | 340.2 | 431.8 |
回答下列问题
(1)
表中 。
(2)
在体积可变的密闭容器中以物质的量之比为1∶1充入
。
(2)
在体积可变的密闭容器中以物质的量之比为1∶1充入 和
和 , 分别在不同压强下发生反应,实验测得乙炔的平衡转化率与温度的关系如图所示。
, 分别在不同压强下发生反应,实验测得乙炔的平衡转化率与温度的关系如图所示。 、
、 、
、 由大到小的顺序为。随温度升高,三条曲线逐渐趋于重合的原因为。
(3)
—定温度下,向盛放催化剂的恒容密闭容器中以物质的量之比为1∶1充入
由大到小的顺序为。随温度升高,三条曲线逐渐趋于重合的原因为。
(3)
—定温度下,向盛放催化剂的恒容密闭容器中以物质的量之比为1∶1充入 和
和 , 假设只发生反应I和II。实验测得反应前容器内压强为
, 假设只发生反应I和II。实验测得反应前容器内压强为 , 10min达到平衡时
, 10min达到平衡时 、
、 的分压分别为
的分压分别为 、
、 。
(4)
科学家发现反应I在催化剂Au/C作用下的反应历程如图所示。“2→3”的化学方程式可表示为:
。
(4)
科学家发现反应I在催化剂Au/C作用下的反应历程如图所示。“2→3”的化学方程式可表示为:

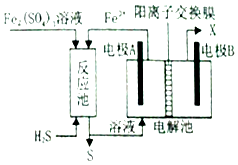
①0~10min内,HCl的总消耗速率Pa/min(用分压表示)。
②反应I的平衡常数(用含
、
、
的代数式表示)。

①“4→5”的化学方程式为。
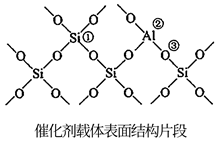
②反应物在催化剂表面经历过程“扩散→吸附(活性位点)→表面反应→脱附”。若保持体系中分压不变,HCl分压过高时反应催化效率降低的可能原因是。
【考点】
反应热和焓变;
化学平衡常数;
能力提升
真题演练




 (g) ∆H1<0
(g) ∆H1<0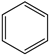 (g)+15O2(g)⇌12CO2(g)+6H2O(l) ∆H4
(g)+15O2(g)⇌12CO2(g)+6H2O(l) ∆H4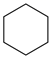 (g)+9O2(g)=6CO2(g)+6H2O(l) ∆H5
(g)+9O2(g)=6CO2(g)+6H2O(l) ∆H5