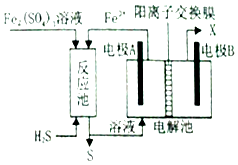
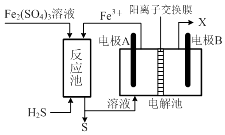
1.
苯催化加氢制备环己烷是化工生产中的重要工艺,一定条件下,发生如下反应:
Ⅰ.主反应: ![]() (g)+3H2(g)⇌
(g)+3H2(g)⇌  (g) ∆H1<0
(g) ∆H1<0
Ⅱ.副反应:  (g) ⇌
(g) ⇌ ![]() (g) ∆H2>0
(g) ∆H2>0
回答下列问题:
(1)
已知:Ⅲ.  (2)
有利于提高平衡体系中环己烷体积分数的措施有_______。
A.
适当升温
B.
适当降温
C.
适当加压
D.
适当减压
(3)
反应Ⅰ在管式反应器中进行,实际投料往往在
(2)
有利于提高平衡体系中环己烷体积分数的措施有_______。
A.
适当升温
B.
适当降温
C.
适当加压
D.
适当减压
(3)
反应Ⅰ在管式反应器中进行,实际投料往往在  的基础上适当增大
的基础上适当增大  用量,其目的是。
(4)
氢原子和苯分子吸附在催化剂表面活性中心时,才能发生反应,机理如图。当
用量,其目的是。
(4)
氢原子和苯分子吸附在催化剂表面活性中心时,才能发生反应,机理如图。当  中混有微量
中混有微量  或
或  等杂质时,会导致反应Ⅰ的产率降低,推测其可能原因为。
(5)
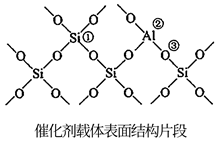
催化剂载体中的酸性中心能催化苯及环己烷的裂解。已知酸性中心可结合弧电子对,下图中可作为酸性中心的原子的标号是(填“①”“②”或“③”)。
(6)
恒压反应器中,按照
等杂质时,会导致反应Ⅰ的产率降低,推测其可能原因为。
(5)
催化剂载体中的酸性中心能催化苯及环己烷的裂解。已知酸性中心可结合弧电子对,下图中可作为酸性中心的原子的标号是(填“①”“②”或“③”)。
(6)
恒压反应器中,按照  投料,发生Ⅰ、Ⅱ反应,总压为
投料,发生Ⅰ、Ⅱ反应,总压为  ,平衡时苯的转化率为α,环己烷的分压为p,则反应1的
,平衡时苯的转化率为α,环己烷的分压为p,则反应1的  (列出计算式即可,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(列出计算式即可,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
Ⅳ.2 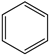 (g)+15O2(g)⇌12CO2(g)+6H2O(l) ∆H4
(g)+15O2(g)⇌12CO2(g)+6H2O(l) ∆H4
Ⅴ. 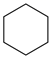 (g)+9O2(g)=6CO2(g)+6H2O(l) ∆H5
(g)+9O2(g)=6CO2(g)+6H2O(l) ∆H5
则 (用
、
和
表示)。

【考点】
反应热和焓变;
盖斯定律及其应用;
化学平衡常数;
化学平衡移动原理;
化学平衡的计算;
能力提升