1.
利用1-甲基萘(1-MN)制备四氢萘类物质(MTLs,包括1-MTL和5-MTL)。反应过程中伴有生成十氢茶(1-MD)的副反应,涉及反应如图:

回答下列问题:
(1)
已知一定条件下反应R1、R2 , R3的焓变分别为△H1 , △H2、△H3 , 则反应R4的焓变为(用含△H1、△H2、△H3的代数式表示)。
(2)
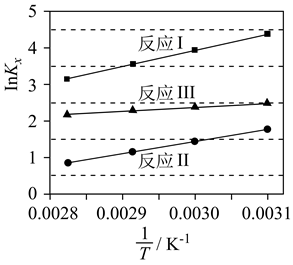
四个平衡体系的平衡常数与温度的关系如图甲所示。
(3)
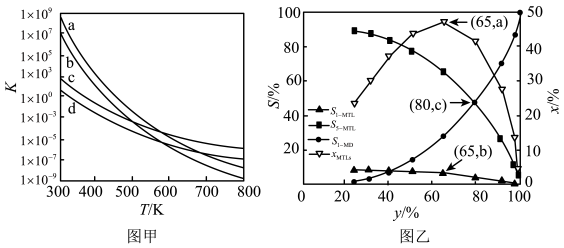
1-MN在6.0×103kPa的高压H2氛围下反应(H2压强近似等于总压)。不同温度下达平衡时各产物的选择性Si(某生成物i的物质的量与消耗1-MN的物质的量之比)和物质的量分数xi(xi表示物种i与除H2外其他各物种总物质的量之比)随1-MN平衡转化率y的变化关系如图乙所示,1-MN平衡转化率y为80%时,1-MTL的产率=;y为65%时反应R1的平衡常数Kp=kPa-2。四氢萘类物质的物质的量分数xi随1-MN平衡转化率先增大后减小,结合平衡移动原理解释原因。
①c、d分别为反应R1和R3的平衡常数随温度变化的曲线,则表示反应R2的平衡常数随温度变化曲线为。
②已知反应R1的速率方程v正=k正•c(1-MN)•c2(H2),v逆=k逆•c(5-MTL)(k正、k逆分别为正、逆反应速率常数,只与温度、催化剂有关)。温度T1下反应达到平衡时k正=1.5k逆 , 温度T2下反应达到平衡时k正=3k逆。由此推知,T1T2(填“>”,“<”或“=”)。
③下列说法错误的是。
A.四个反应均为放热反应 B.压强越大,温度越低越有利于生成四氢萘类物质
C.反应体系中1-MD最稳定 D.由上述信息可知,400K时反应R4速率最快
【考点】
化学平衡转化过程中的变化曲线;
化学反应速率与化学平衡的综合应用;
能力提升
真题演练







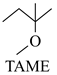 △H1
△H1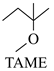 △H2
△H2