1.
(1)
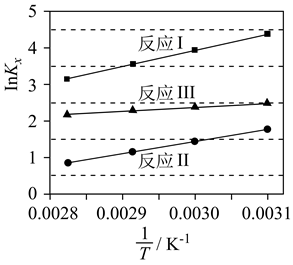
I. 是化学活动性极强的气体。高温下,将一定量的
是化学活动性极强的气体。高温下,将一定量的 与
与 充入2.5L的空钢瓶中,发生反应:
充入2.5L的空钢瓶中,发生反应: 。相关数据如下表。
。相关数据如下表。
(2)
向反应器中再分别充入下列气体,能使 平衡转化率增大的是。(选填编号)
(3)
II.
平衡转化率增大的是。(选填编号)
(3)
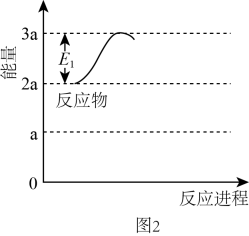
II. 可在氧气中燃烧,反应式为:
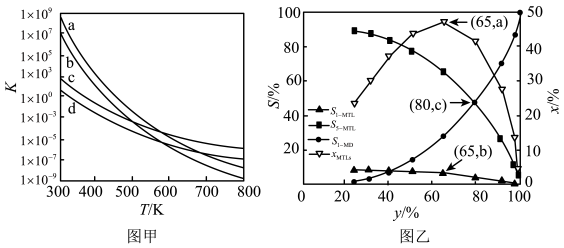
可在氧气中燃烧,反应式为: 。研究人员对影响产率的反应条件进行了研究:保持其他条件不变,测定反应至相同时间时产率随温度的变化。所得结果如图所示。
(4)
III.另一种
。研究人员对影响产率的反应条件进行了研究:保持其他条件不变,测定反应至相同时间时产率随温度的变化。所得结果如图所示。
(4)
III.另一种 吸收效率更高的工艺是:将
吸收效率更高的工艺是:将 与
与 分别缓慢通入
分别缓慢通入 、
、 的混合溶液中反应回收S,其物质转化如图所示。
(5)
已知常温下CuS不与
的混合溶液中反应回收S,其物质转化如图所示。
(5)
已知常温下CuS不与 发生反应,则过程中通入
发生反应,则过程中通入 的作用是;为保证
的作用是;为保证 全部转化为S,通入
全部转化为S,通入 和
和 的体积比至少为。
的体积比至少为。
温度(K) | 起始反应物的量(mol) | 平衡时 | |
500 | 0.40 | 0.10 | 0.02 |
600 | 0.40 | 0.10 | 0.03 |
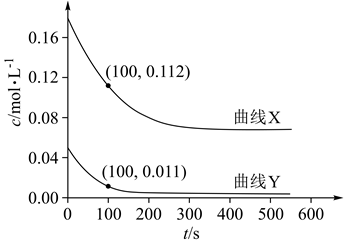
该反应是(选填“吸热”或“放热”)反应;500K时,反应5min时达到平衡,则0~5min内,的平均反应速率
;600K时,达到平衡所需时间(选填“大于”“小于”或“等于”)5min。
a. b.
c.COS d.

请解释产率先增大后减小的原因。

请写出与
反应的离子方程式;在上述吸收过程中,理论上无需添加的物质是。
【考点】
化学平衡转化过程中的变化曲线;
化学反应速率与化学平衡的综合应用;
能力提升
真题演练






 △H1
△H1 △H2
△H2