1.
硫酸亚铁铵[(NH4)2Fe(SO4)2·6H2O]常称为摩尔盐,溶于水且溶解度随温度升高而增大,不易溶于乙醇,在空气中不易被氧化,比硫酸亚铁稳定,常用来配制亚铁离子溶液。实验制备步骤如图:

(1)
步骤①中硫酸浓度应选择。(选填编号)
(2)
在制备FeSO4的过程中,铁粉与硫酸的物质的量比宜控制在0.8~0.9左右。当n(Fe):n(H2SO4)>1时,由于硫酸的殆尽,增加了Fe2+的水解,降低了产率和产品质量。当n(Fe):n(H2SO4)<0.7时,也降低了产率和产品质量,分析其原因是: 。
(3)
步骤②中“混合反应”时温度需控制在70~80℃,可采取的措施是。步骤③中,从溶液中提取硫酸亚铁铵的系列操作中包含蒸发浓缩、 、 、乙醇洗涤、干燥。
(4)
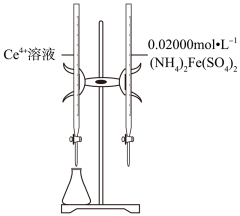
为测定产品中摩尔盐的质量分数,研究小组称量产品24.50g配成100mL溶液,量取10.00mL,用0.1000mol•L﹣1KMnO4酸性溶液滴定,消耗KMnO4溶液12.25mL。已知: +5Fe2++8H+=Mn2++5Fe3++4H2O
(5)
判断反应到达滴定终点的现象为。产品中摩尔盐的质量分数。
+5Fe2++8H+=Mn2++5Fe3++4H2O
(5)
判断反应到达滴定终点的现象为。产品中摩尔盐的质量分数。
a.98%浓硫酸b.3mol•L﹣1硫酸c.15mol•L﹣1硫酸d.0.05mol•L﹣1硫酸
实验室配制100mL一定浓度的摩尔盐溶液,用到的玻璃仪器有:烧杯、玻璃棒、、。
【考点】
探究物质的组成或测量物质的含量;
制备实验方案的设计;
能力提升
真题演练