1.
配位化学的应用十分广泛,在经济、生产、生活等方面都有重要作用。
(1)
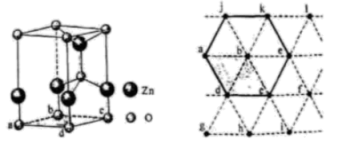
在配合物中部分分子或离子与中心离子较紧密地结合在一起,组成在溶液中能够稳定存在的整体,称为“内界”{书写时用“[ ]”与外界分离}。与中心离子结合不够紧密的离子则处于“外界”。内界和外界不同,物质的性质也不同,如CoCl3与NH3形成的三种配合物A、B、C,Co3+的配位数均为6,但它们的颜色各异,如果各取1molA、B、C溶于水,加入足量硝酸银溶液,分别产生1mol、2mol、3mol白色沉淀。则它们的化学式分别为A:;B:,C:,它们的配体分别是A:;B:;C:。
(2)
甲醇和CO合成乙酸时,使用铑羰基化合物[Rh(CO)2I2]-作为催化剂,使得原本需要高压下才能进行的反应在低压下也能进行。其催化机理如图:

①根据Rh的化合价可将I、II、III、IV、V分为:
1)化合价价,包含;
2)化合价价,包含;(有几种化合价填几类,可不填满,也可增加)
②上述机理中包括步反应,其中一步为氧化加成,该步反应的方程式为。
【考点】
配合物的成键情况;
能力提升
真题演练


 离子组成。
离子组成。
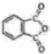 )和邻苯二甲酰亚胺(
)和邻苯二甲酰亚胺(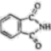 )都是合成菁的原料,后者熔点高于前者,主要原因是。
)都是合成菁的原料,后者熔点高于前者,主要原因是。