1.
研究CO2的综合利用、实现CO2资源化,是能源领域的重要发展方向,也是力争2030年前实现碳达峰、2060年前实现碳中和的方向之一、
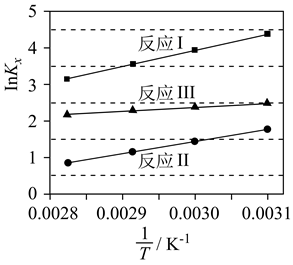
已知:反应I:CO2(g)+H2(g)→CO(g)+H2O(g) ΔH1=+41.2kJ/mol
反应II:2CO(g)+4H2(g)→C2H4(g)+2H2O(g) ΔH2=-332kJ/mol
反应III:2CO2(g)+6H2(g)→C2H4(g)+4H2O(g) ΔH3
(1)
反应III中,ΔH3=kJ/mol。
(2)
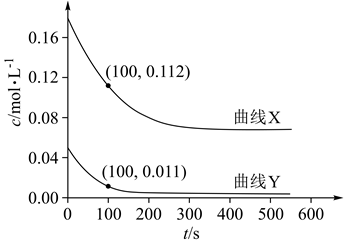
在体积为2L的刚性密闭容器中,充入1molCO和2molH2 , 发生反应II,能判断反应达到平衡状态的是(填字母序号)。
(3)
在体积为2L的恒压密闭容器中,起始充入1molCO2(g)和3molH2(g),发生反应III,该反应在不同温度下达到平衡时,各组分的体积分数随温度的变化如图所示。
a.2(H2)=
(H2O) b.容器内压强保持不变
c.保持不变 d.C2H4的质量分数保持不变

①表示H2和C2H4的体积分数随温度变化的曲线分别是(填字母序号)。
②A、B、C三点对应的化学平衡常数KA、KB、KC从大到小的顺序为。
③240℃时,反应达到平衡后,容器中气体的总物质的量为mol,H2(g)的平衡转化率为。若平衡时总压为P,该反应的平衡常数Kp=(列出计算式。用平衡分压代替平衡浓度计算,分压=总压x物质的量分数)。
【考点】
反应热和焓变;
化学反应速率与化学平衡的综合应用;
能力提升
真题演练






 △H1
△H1 △H2
△H2