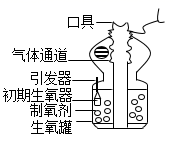
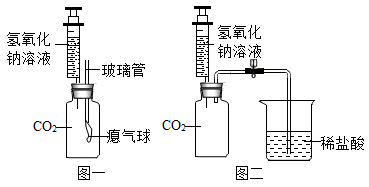
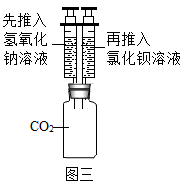
1.
酸碱中和反应是两类物质的一类反应。某班同学分为五个小组对该类反应进行探究。
(1)
分组探究,收集证据
(2)
得出结论,解释应用



①第一组观察到的现象,证明反应发生了。
②第二组将稀硫酸滴加到盛有氢氧化钠固体的试管中,测得该过程中温度升高。经讨论分析,此现象不能作为该反应发生的证据,理由是。
③第三组向滴有酚酞的氢氧化钠溶液中滴加稀硝酸至溶液恰好变为无色,回滴一滴氢氧化钠溶液,溶液又变为红色,从溶液酸碱性的变化证明反应发生了,该反应的化学方程式为。
④第四组将所选的酸碱溶液充分混合后,将混合溶液蒸发结晶,理论上可得固体g,证明该反应发生了。
⑤第五组将所选的酸碱溶液充分混合后,未观察到明显现象,再向混合后的溶液中滴加溶质质量分数为5%的Na2CO3溶液,烧杯中溶液质量与滴加Na2CO3溶液的质量关系如第五组坐标图所示。图示信息(填“能”或“不能”)作为稀盐酸和氢氧化钙发生反应的证据,理由是。
通过探究可知,不同的酸和不同的碱能发生中和反应,该类反应的共性是:不同酸中的H+和不同碱中的OH-相互作用生成水分子,此类反应有广泛的用途,如农业上常用改良酸性土壤。(填一种物质的名称或化学式)
【考点】
实验探究物质的性质或变化规律;
化学实验方案设计与评价;
能力提升
真题演练