1.
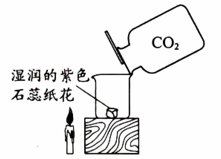
请从A或B两题中任选1个作答。如图在三只试管中进行实验。
|
A |
B |
||||
|
①固体溶解形成紫色溶液 | ②固体几乎不溶解 | ③固体溶解,形成紫红色溶液 | ①紫色石蕊小花不变红 | ②紫色石蕊小花不变红 | ③紫色石蕊小花变红 |
| ⑴对比实验①、②的现象,可得出的结论是。 ⑵设计实验②、③的目的是。 | ⑴设计实验①的目的是。 ⑵对比实验①、②、③的现象,可得出的结论是。 | ||||
【考点】
实验探究物质的性质或变化规律;
能力提升
变式训练
拓展培优
真题演练







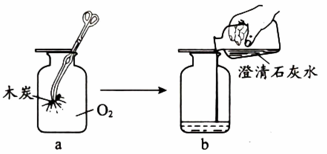 实验2
实验2