1.
过氧乙酸(CH3CO3H)是一种广谱高效消毒剂,不稳定、易分解,高浓度易爆炸。常用于空气、器材的消毒,可由乙酸与H2O2在硫酸催化下反应制得,热化学方程式为:CH3COOH(aq)+H2O2(aq)⇌CH3CO3H(aq)+H2O(l) △H=-13.7KJ/mol
(1)
市售过氧乙酸的浓度一般不超过21%,原因是
。
(2)
利用上述反应制备760 9 CH3CO3H,放出的热量为kJ。
(3)
取质量相等的冰醋酸和50% H2O2溶液混合均匀,在一定量硫酸催化下进行如下实验。
(4)
SV-1、SV-2是两种常用于实验研究的病毒,粒径分别为40
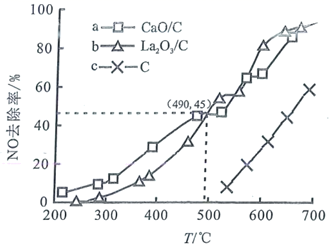
nm和70 nm。病毒在水中可能会聚集成团簇。不同pH下,病毒团簇粒径及过氧乙酸对两种病毒的相对杀灭速率分别如图3、图4所示。
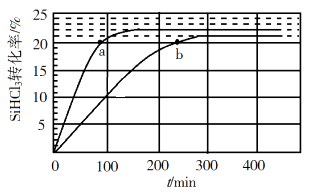
实验1:在25 ℃下,测定不同时间所得溶液中过氧乙酸的质量分数。数据如图1所示。
实验2:在不同温度下反应,测定24小时所得溶液中过氧乙酸的质量分数,数据如图2所示。

①实验1中,若反应混合液的总质量为mg,依据图1数据计算,在0—6h间,v(CH3CO3H)= g/h(用含m的代数式表示)。
②综合图1、图2分析,与20 ℃相比,25 ℃时过氧乙酸产率降低的可能原因是。(写出2条)。

依据图3、图4分析,过氧乙酸对SV-1的杀灭速率随pH增大而增大的原因可能是
【考点】
化学反应速率的影响因素;
化学平衡的影响因素;
能力提升
真题演练