1.
三氯氢硅(SiHCl3)是制备硅烷、多晶硅的重要原料。回答下列问题:
(1)
SiHCl3在常温常压下为易挥发的无色透明液体,遇潮气时发烟生成(HSiO)2O等,写出该反应的化学方程式。
(2)
SiHCl3在催化剂作用下发生反应:
(3)
对于反应2SiHCl3(g)=SiH2Cl2(g)+SiCl4(g),采用大孔弱碱性阴离子交换树脂催化剂,在323 K和343 K时SiHCl3的转化率随时间变化的结果如图所示。
2SiHCl3(g)=SiH2Cl2(g)+ SiCl4(g) ΔH1=48 kJ·mol−1
3SiH2Cl2(g)=SiH4(g)+2SiHCl3 (g) ΔH2=−30 kJ·mol−1
则反应4SiHCl3(g)=SiH4(g)+ 3SiCl4(g)的ΔH= kJ·mol−1。
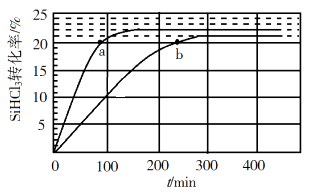
①343 K时反应的平衡转化率α=%。平衡常数K343 K=(保留2位小数)。
②在343 K下:要提高SiHCl3转化率,可采取的措施是;要缩短反应达到平衡的时间,可采取的措施有、。
③比较a、b处反应速率大小:vavb(填“大于”“小于”或“等于”)。反应速率v=v正−v逆= −
,k正、k逆分别为正、逆向反应速率常数,x为物质的量分数,计算a处
=(保留1位小数)。
【考点】
盖斯定律及其应用;
化学反应速率的影响因素;
化学平衡的影响因素;
化学平衡转化过程中的变化曲线;