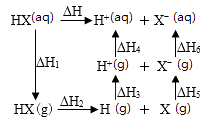1.
环戊二烯(  )是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产。回答下列问题:
)是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产。回答下列问题:
 )是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产。回答下列问题:
)是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产。回答下列问题: 已知: ![]() (g) =
(g) = ![]() (g)+H2(g) ΔH1=100.3 kJ·mol −1 ①
(g)+H2(g) ΔH1=100.3 kJ·mol −1 ①
H2(g)+ I2(g) =2HI(g) ΔH2=−11.0 kJ·mol −1 ②
对于反应: ![]() (g)+ I2(g) =
(g)+ I2(g) = ![]() (g)+2HI(g) ③ ΔH3=kJ·mol −1。
(g)+2HI(g) ③ ΔH3=kJ·mol −1。
【考点】
盖斯定律及其应用;