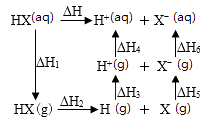1.
由金红石(TiO2)制取单质Ti,涉及的步骤为:TiO2→TiCl4  Ti
Ti
已知:①C(s)+O2(g)═CO2(g);△H=﹣393.4KJ/mol
②2CO(g)+O2(g)═2CO2(g);△H=﹣556KJ/mol
③TiO2(s)+2Cl2(g)═TiCl4(s)+O2(g);△H=+141KJ/mol
则:TiO2(s)+2Cl2(g)+2C(s)═TiCl4(s)+2CO2(g);△H=.
【考点】
盖斯定律及其应用;