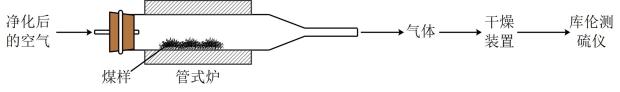
1.
“碘钟”实验中,3I﹣+S2O82﹣=I3﹣+2SO42﹣的反应速率可以用I3﹣与加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大.某探究性学习小组在20℃进行实验,得到的数据如下表:
实验编号 | ① | ② | ③ | ④ | ⑤ |
c(I﹣)/mol•L﹣1 | 0.040 | 0.080 | 0.080 | 0.160 | 0.120 |
c(S2O82﹣)/mol•L﹣1 | 0.040 | 0.040 | 0.080 | 0.020 | 0.040 |
t/s | 88.0 | 44.0 | 22.0 | 44.0 | t2 |
回答下列问题:
(1)
该实验的目的是.
(2)
显色时间t2=.
(3)
温度对该反应的反应速率的影响符合一般规律,若在40℃下进行编号③对应浓度的实验,显色时间t2的范围为 (填字母).
A.
<22.0s
B.
22.0~44.0s
C.
>44.0s
D.
数据不足,无法判断
(4)
通过分析比较上表数据,得到的结论是
【考点】
化学反应速率的影响因素;